¿Alguna vez has pensado en cómo algunos de estos medicamentos son efectivos simplemente deteniendo las reacciones adversas en el cuerpo? ¿O por qué se reduce el deterioro de los alimentos al refrigerarlos? La respuesta es... inactivación enzimática que está ampliamente involucrado en la biología, la medicina y la industria.
En realidad, las enzimas son proteínas que actúan como catalizadores biológicos que aumentan la velocidad a la que se producen las reacciones químicas y, en algunos casos, su actividad requiere regulación. Inactivación enzimática Por lo tanto, pueden considerarse inhibidores de enzimas o inhibidores de enzimas, independientemente de los métodos empleados. inactivación enzimática El conocimiento de cómo se inactivan las enzimas juega un papel vital en el desarrollo de medicamentos, la conservación de alimentos y el control de enfermedades.
En este artículo, el lector también aprenderá qué es inactivación enzimática Es decir, cómo se produce y su importancia en diferentes ámbitos.
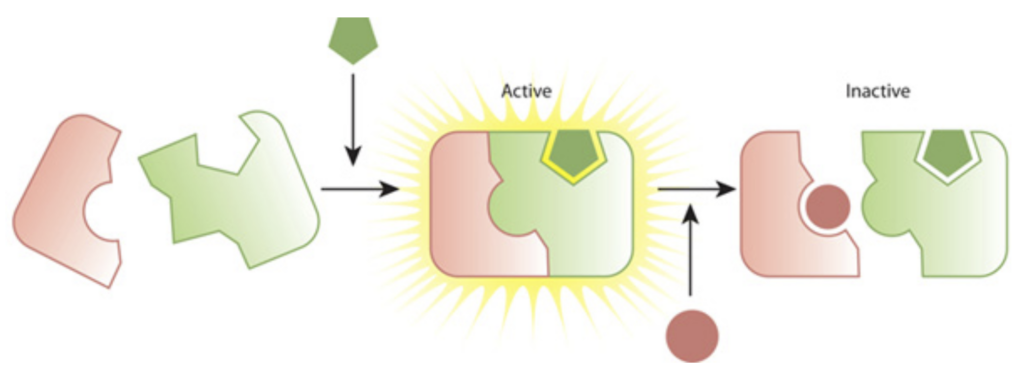
¿Qué es la inactivación enzimática?
Enzima inactivación Se refiere al proceso en el que una enzima, con propiedades catalíticas para una reacción determinada, deja de catalizar dicha reacción. Esto puede ser a corto o largo plazo, según la causa.
Características principales de la inactivación enzimática:
- Pérdida de actividad enzimática debido a cambios estructurales.
- Puede ser no competitivo o competitivo dependiendo de la naturaleza de la inhibición.
- Se presentan tanto como sustancias naturales como compuestos producidos artificialmente que tienen impacto en el metabolismo, la medicina y la biotecnología.
Por ejemplo, ¿alguna vez has considerado una situación en la que las enzimas del tracto gastrointestinal dejan de funcionar? El cuerpo no podrá digerir los alimentos para obtener energía. Por eso, la inactivación de las enzimas es un proceso igualmente importante y estrictamente controlado.
Causas de la inactivación enzimática
Existen diferentes causas que pueden provocar inactivación enzimática como se explica a continuación:
1. Cambios de temperatura
Se sabe que las enzimas actúan a temperaturas óptimas y, por lo tanto, tienen diferentes temperaturas que son las más apropiadas para actuar. El calor puede inactivar las enzimas que participan en la mejora de su estructura y la formación de nuevas estructuras más eficaces. Por ello, cocinar los alimentos elimina las bacterias; las enzimas se desnaturalizan. Por otro lado, el almacenamiento de alimentos reduce la actividad de las enzimas responsables de su deterioro.
2. Variaciones del pH
Las enzimas también tienen un rango de pH óptimo en el que realizan sus funciones eficientemente. Una acidez o alcalinidad elevadas influyen en la forma de la enzima, lo que a su vez afecta su capacidad para funcionar o no. Por ejemplo, la pepsina, una enzima digestiva del estómago, es activa en un entorno ácido, mientras que la amilasa de la saliva lo es en un entorno neutro.
3. Agentes químicos
Algunas sustancias, entre las que se incluyen metales pesados, detergentes y disolventes, actúan alterando la estructura de las enzimas y, por lo tanto, se unen. inhibición enzimática irreversible . Most of the poisons or toxins are known to work by irreversibly going for the enzymes’ activity. For instance, cyanide inhibits cytochrome c oxidase that forms an important enzyme in cellular respiration hence leading to quick cell death.
4. Acumulación de sustrato o producto
El sustrato y el producto parecen inhibir la actividad enzimática. Si sus concentraciones son altas, la velocidad de reacción se ralentiza o se detiene por completo. Este es un mecanismo de retroalimentación común que ayuda a eliminar la acumulación de ciertas sustancias en los procesos metabólicos.
5. Mutaciones genéticas
Las alteraciones en los genes que codifican enzimas pueden provocar la formación de enzimas no funcionales, causando enfermedades por deficiencia de enzimas. Algunos trastornos metabólicos incluyen la fenilcetonuria (PKU), que puede clasificarse como enzimopatía, ya que se origina a partir de enzimas no funcionales que deben controlarse mediante dieta o medicación.
Mecanismos de inhibición enzimática

Estos mecanismos tienen como objetivo regular la actividad enzimática del organismo, ya sea temporal o permanentemente. Existen dos tipos principales:
1. Inhibición enzimática reversible
En este tipo de mecanismo de inhibición enzimática La actividad enzimática siempre se puede recuperar una vez eliminado el inhibidor en uso. Existen tres tipos:
- Inhibición competitiva: Un inhibidor se une directamente al sustrato y tiene una forma similar a la de este para encajar en el sitio activo de la enzima. Un ejemplo de fármacos que inhiben la actividad enzimática es cuando se unen a los sitios activos debido a su estructura similar a la de las sustancias que normalmente se unen allí. Un buen ejemplo es el metotrexato, que actúa deteniendo la acción de la dihidrofolato reductasa, ralentizando así el crecimiento de las células cancerosas.
- Inhibición no competitiva: El inhibidor no se une al sitio activo, sino que interactúa con otros sitios de la enzima, alterando así su forma y disminuyendo su actividad. Esto se observa ampliamente en los procesos de regulación metabólica.
En este caso, el inhibidor solo se une al complejo enzima-sustrato y la reacción nunca finaliza. Esto se utiliza en algunos fármacos para aumentar la selectividad hacia el objetivo. Dado que algunos fármacos contienen varias moléculas diana, este mecanismo se utiliza para aumentar la selectividad del fármaco hacia un objetivo específico.
2. Inhibición enzimática irreversible
En esta forma de inhibición enzimática irreversible El inhibidor forma un enlace covalente con la enzima, un enlace permanente que priva a la enzima de su funcionalidad. Esto se observa en:
- Enlace covalente: Se une directamente a la enzima mediante una conexión química que hace que el inhibidor se desvincule permanentemente. Por ejemplo, los gases nerviosos interfieren con la función enzimática del sistema nervioso.
- Inactivación del sitio activo: Muchos inhibidores debilitan o alteran la forma del sitio activo de modo que la enzima no puede reconocer el sustrato.
No creerías que muchos antibióticos actúan a través de mecanismos de inhibición enzimática irreversible , por lo que las bacterias no pueden crecer.
Aplicaciones de la inactivación enzimática
1. Industria farmacéutica
Mecanismo de inhibición enzimática Es un enfoque común en el diseño de fármacos para el tratamiento de enfermedades. Por ejemplo, las estatinas reducen la actividad de las enzimas que sintetizan el colesterol y, por lo tanto, disminuyen el riesgo de enfermedades cardíacas. De igual manera, los inhibidores de la proteasa también se utilizan como medicamentos contra el VIH, ya que previenen la replicación del virus.
2. Conservación de alimentos
El calor y los conservantes químicos destruyen estas enzimas en los alimentos, reduciendo así su tiempo de descomposición. En el caso de la pasteurización, el uso de enzimas para inactivar las bacterias en la leche la hace segura para el consumo. Además, antes de congelarlas, las verduras deben blanquearse para reducir la actividad enzimática que provoca su descomposición.
3. Agricultura y control de plagas
El uso de pesticidas implica la inmovilización de enzimas específicas en insectos y malezas para evitar que representen una amenaza para los cultivos. Por ejemplo, los agentes organofosforados inhiben la acetilcolinesterasa, lo que provoca la parálisis de los insectos.
4. Trastornos metabólicos
Algunos trastornos genéticos, como la fenilcetonuria, requieren el uso de enzimas que no se producen adecuadamente, por lo que se requiere un procedimiento para neutralizarlas. Se está trabajando en el desarrollo de terapias de reemplazo enzimático para tratar a las personas afectadas con deficiencias enzimáticas.
5. Aplicaciones industriales y biotecnológicas
En la biotecnología actual, existe la necesidad de controlar inactivación enzimática Para detener reacciones indeseadas. Por ejemplo, las enzimas utilizadas en las industrias cervecera y láctea se tratan térmicamente deliberadamente para obtener los sabores y texturas deseados.

Técnicas experimentales para el estudio de la inactivación enzimática
Existen diferentes métodos de investigación que emplean los científicos para examinar inactivación enzimática y también para el desarrollo de inhibidores para su uso en medicina y otras industrias. Estos incluyen:
- Espectrofotometría: Mide la actividad enzimática antes y después de la exposición a inhibidores.
- Cristalografía de rayos X: Determina los cambios estructurales de las enzimas tras la inactivación.
- Acoplamiento molecular: Esto imita el comportamiento de los inhibidores en relación con las enzimas a nivel molecular.
Conclusión
Inactivación enzimática es un proceso muy significativo en la medicina, la industria y nuestra vida diaria. mecanismos de inhibición enzimática o inhibición enzimática irreversible La regulación de las enzimas es muy importante en la salud, la biotecnología y el procesamiento de alimentos.
El conocimiento de estos procesos ayuda a los científicos a formular mejores medicamentos, técnicas de conservación de alimentos e incluso a combatir enfermedades. La próxima vez que tomes una pastilla o comas comida enlatada, te darás cuenta de que... inactivación enzimática ¡Está en juego! Para más detalles, visite nuestro sección del blog!
Preguntas frecuentes
- ¿Qué es la inactivación enzimática?
Inactivación enzimática Por otro lado está la reducción de la actividad enzimática ya que su estructura ha cambiado y por lo tanto no puede catalizar reacciones.
- ¿Cómo funciona la inhibición enzimática irreversible?
It inactivates an enzyme through other mechanisms, which are usually covalent modifications to the enzyme’s active site and renders it non-functional.
- ¿Cuáles son las causas comunes de inactivación enzimática?
Las enzimas pueden inactivarse por cambios de temperatura, cambios en los niveles de pH, presencia de sustancias químicas y mutaciones genéticas.
- ¿Por qué es importante la inactivación enzimática en medicina?
Desempeña un papel importante en el desarrollo de fármacos mediante el desarrollo de toxinas que reaccionan ante enzimas peligrosas, como por ejemplo bacterias o enzimas metabólicas que causan enfermedades.
- ¿Cómo se explica el hecho de que se pueda inhibir la acción de las enzimas en la conservación de los alimentos?
El calor y los conservantes químicos matan las enzimas que provocan el deterioro y aumentan el tiempo durante el cual se pueden almacenar los alimentos.
